2025-04-24
32
微生物污染是威胁药品安全性和有效性的关键风险因素。研究表明,受微生物污染药品不仅导致治疗指数显著下降,更可能引发医源性感染等严重药害事件。作为药品质量控制的基石,我国自1953年首部《中华人民共和国药典》实施以来,持续构建微生物污染防控体系,药品微生物控制也逐渐从被动检测向主动管控转变。至2025年版药典第四部,通过整合吸收了ICH Q4B等一系列国际规范,形成了涵盖10项技术通则(包括通则1101无菌检查法、1105微生物限度检查法等)和16项指导原则(如9203药品微生物实验室质量管理指导原则)的微生物质量控制标准体系。该体系的建立,标志着我国药品微生物控制实现从经验判断向质量源于设计(QbD)模式的范式转变,检测方法学与国际接轨,风险控制维度由单一终产品检测扩展至全过程监测(涵盖原辅料、生产环境等多个关键控制点)。药品微生物控制领域"标准升级驱动质量跃迁"的规律。
一、ICH指导原则的转化
为减少因标准差异带来的贸易阻滞,ICHQ4B附录8等的转化工作接近完成,吸收融合后修订了通则与指导原则。
1. 无菌检查
2025版药典对无菌检查方法进行了系统性优化。通则1101无菌检查法理顺和明确无菌检查法的关键性技术要求。原则上与ICH协调案保持一致,完善方法适用性试验中的菌种选择,将大肠埃希菌调整为铜绿假单胞菌。取消了无菌检查法中生物制品硫乙醇酸盐流体培养基置于20-25℃培养的强制性要求
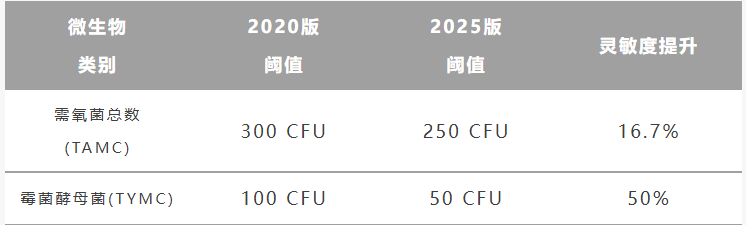
2. 微生物限度检查
通则1105非无菌产品微生物限度检查实现了与国际标准的接轨:
3. 抑菌效力检查
新增指导原则1121抑菌效力检查法,要求非无菌制剂必须通过微生物挑战试验验证防腐效能。采用分级评价体系,根据产品类型设定不同的抑菌效果标准。例如,口服制剂需在14天内使接种菌量下降≥1.0 log,而注射剂则要求7天内下降≥3.0 log。该方法同步引入定量PCR技术,实现抑菌效力的快速定量评估。
4. 水分活度
首次将水分活度(Aw)纳入微生物风险评估体系。通则9203药品微生物实验室质量管理指导原则要求对非无菌制剂进行Aw测定,并结合产品pH值、包装密封性等参数构建多维度污染预测模型。例如,当Aw<0.6时,可豁免部分微生物限度检查项目,显著降低企业检测成本。
二、基于风险的管理体系升级
1. 风险管理的系统整合
2025版药典整合了ICH Q9质量风险管理核心要素,并参考IEC/ISO 17205标准,构建了覆盖药品全生命周期的微生物控制框架:
2. 药用辅料标准升级
针对辅料微生物污染频发问题,新增药用聚乙烯烃塑料袋的生物负载标准:表面微生物限度从≤1000 CFU/100 cm²收紧至≤100 CFU/100 cm²,且霉菌酵母菌不得检出6。同时要求辅料供应商提供菌种溯源报告,确保污染菌的可追溯性。
3. 制药用水监测革新
新增指导原则9209制药用水微生物监测与控制,从微生物来源、类群、生物膜、细菌内毒素四个方面分析制药用水系统中污染微生物的特殊性和潜在风险;明确检验方法选择、调整的基本要求,指导监测方案和标准的制定,并推荐可使用快速微生物方法;从制药用水全生命周期分析和提示微生物控制要点。
4. 灭菌法修订
修订通则1421灭菌法,将汽相灭菌法修订为汽化灭菌法,理顺和明确汽
化灭菌工艺的定义、应用场景、监测和控制等关键性技术要求。干热灭菌法部分未作修订,干热灭菌条件仍然是二选一,采用温度-时间参数或者结合 FH 值(FH值为标准灭菌时间,系灭菌过程赋予被灭菌物品 160℃下的等效灭菌时间)综合考虑。同时干热可用于除热源。
引入“表面除菌”概念,对于常压下的汽化工艺,用于较大密闭 空间内的表面除菌。不同于传统的湿热灭菌法、干热灭菌法和气体灭菌法等,这类汽化工艺主要对暴露表面的生物负载进行杀灭,穿透力较差,因此使用“表面除菌” 更合适。
三、独特领先理念的实践突破
1. 不可接受微生物监测
新增指导原则9212非无菌产品不可接受微生物风险评估与控制,首次提出不可接受微生物概念,并给出适用范围、常见不可接受微生物的种类、不可接受微生物的风险识别策略、不可接受微生物风险评估的主要特征因素、不可接受微生物的风险控制要点等内容。921指导原则还提供了非无菌产品中不可接受微生物的风险决策树,方便在实践中选用。
2. 洋葱伯克霍尔德菌群检查法
针对该菌在注射剂中的高污染风险,2025版药典首创分子生物学检测流程:
2025年版《中国药典》通过标准国际化、管理精细化与技术创新化构建了全球领先的药品微生物控制体系。在科学性、前瞻性与可操作性上均有了不同程度的提升,下表是一些汇总,以供参考。
