2025-04-24
39
洁净室(区)是无菌产品(药品、制剂、及医疗器械等)生产过程中不可缺少的生产环境,其环境控制水平直接或间接影响无菌产品的质量。洁净区可定义为:
洁净室(区)是指将一定空间范围内的空气中的尘粒、微粒子、有害空气、细菌、微生物等污染物排除,并将室内温度、洁净度、室内压力、气流速度与气流分布、噪音振动及照明、静电控制在某一需求范围内,而所给予特别设计的房间。其建筑结构、装备及其作用均具有减少该房间(区域)内污染源的介入、产生和滞留的功能。不论外在空气条件如何变化,其室内均能具有维持原先所设定要求的洁净度、温湿度及压力等性能的特性。
为保障无菌产品的安全性和有效性,现行法规、规章、标准及规范性文件中均有无菌洁净区的日常监测要求,国内外GMP及其附录大多以ISO 14644系列标准为基础,结合一些相关国标如GB 50457-2019《医药工业洁净厂房设计标准》、GB/T 25915.3-2024《洁净室及相关受控环境 第3部分:检测方法》,辅以行业标准YY/T0033-2000《无菌医疗器具生产管理规范》,及其他洁净室受控环境相关标准的要求指南,搭建洁净区的风险评估、分级体系,制定环境监测计划与应急预案。
洁净室(区)必须要同时对生产环境中的尘埃和微生物加以控制。本文侧重于微生物的监测与控制。洁净区环境监测作为污染控制策略(CCS)的重要组成部分,用于监测旨在将粒子和微生物污染风险降至最低的控制措施。表1汇总了当前主要法规中关于洁净区微生物监测法规核心要求。
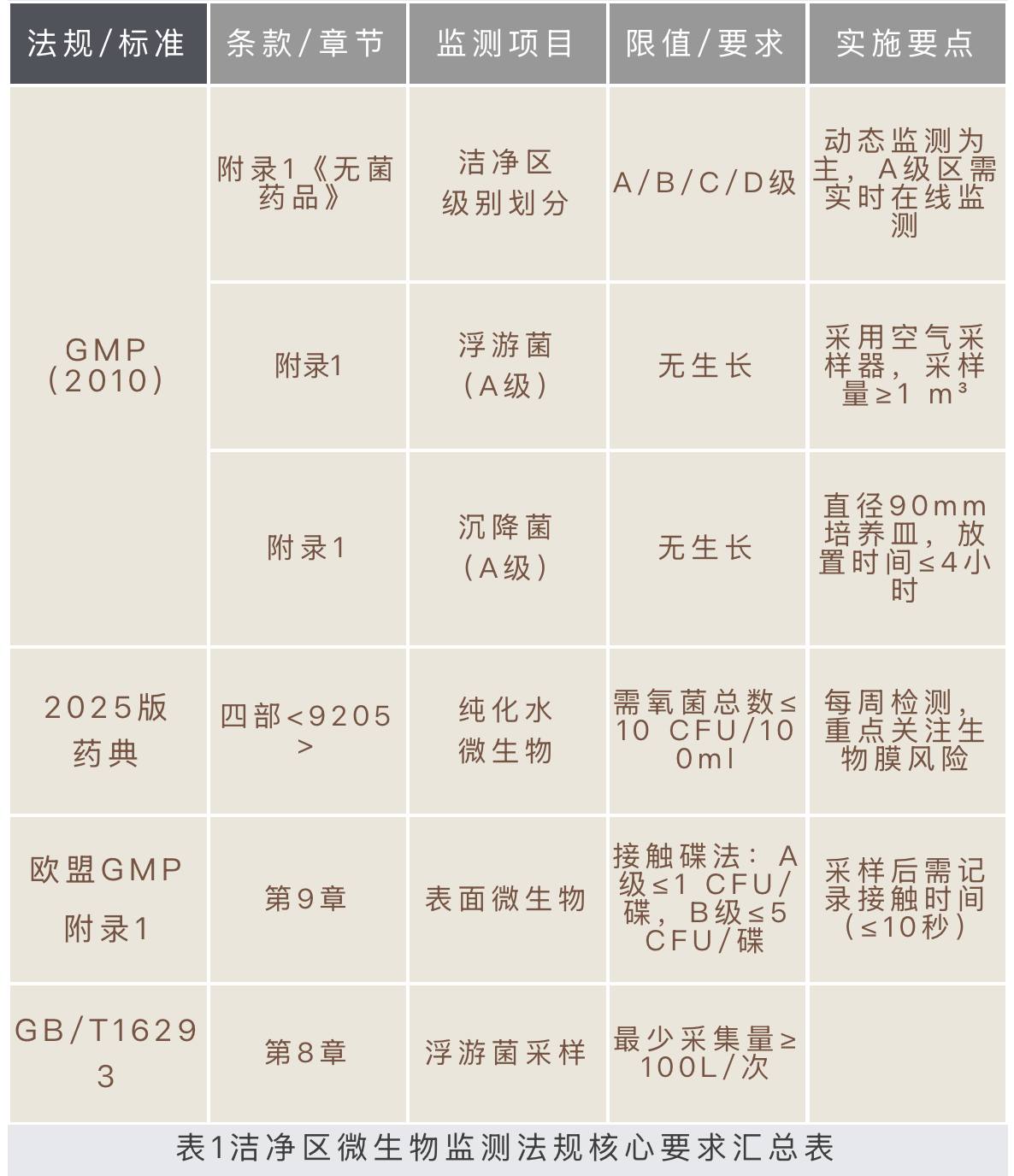
2025版药典
四部9205《药品洁净实验室微生物监测和控制指导原则》也做了修订,更改了培养条件,不再机械设定单一培养条件,而是参考国内外标准及行业实际情况,当环境微生物种群信息不确定时,建议根据监测关注点的不同,选择不同的培养温度及培养时间。相关描述如下:
可根据环境污染微生物的历史数据及种群特性选择特定的培养条件和培养时间。当环境微生物种群信息不确定时,可根据监测关注点的不同选择不同的培养条件,如先在20℃~25℃培养3~5天后再转移至30℃~35℃培养2~3天,或先在30℃~35℃培养2~3天后再转移至20℃~25℃培养3~5天。不同的培养方式均存在一定的监测盲点。当已知污染微生物生长缓慢时,应适当延长培养时间。当监测结果有疑似真菌或考虑季节因素影响时,可增加沙氏葡萄糖琼脂培养基(SDA),培养温度为20℃~25℃,时间为5~7天。
表2为洁净级别环境微生物监测的动态标准,GMP药品生产质量管理规范(2010年修订)》无菌药品附录(征求意见稿)与2025版药典四部9205基本一致。
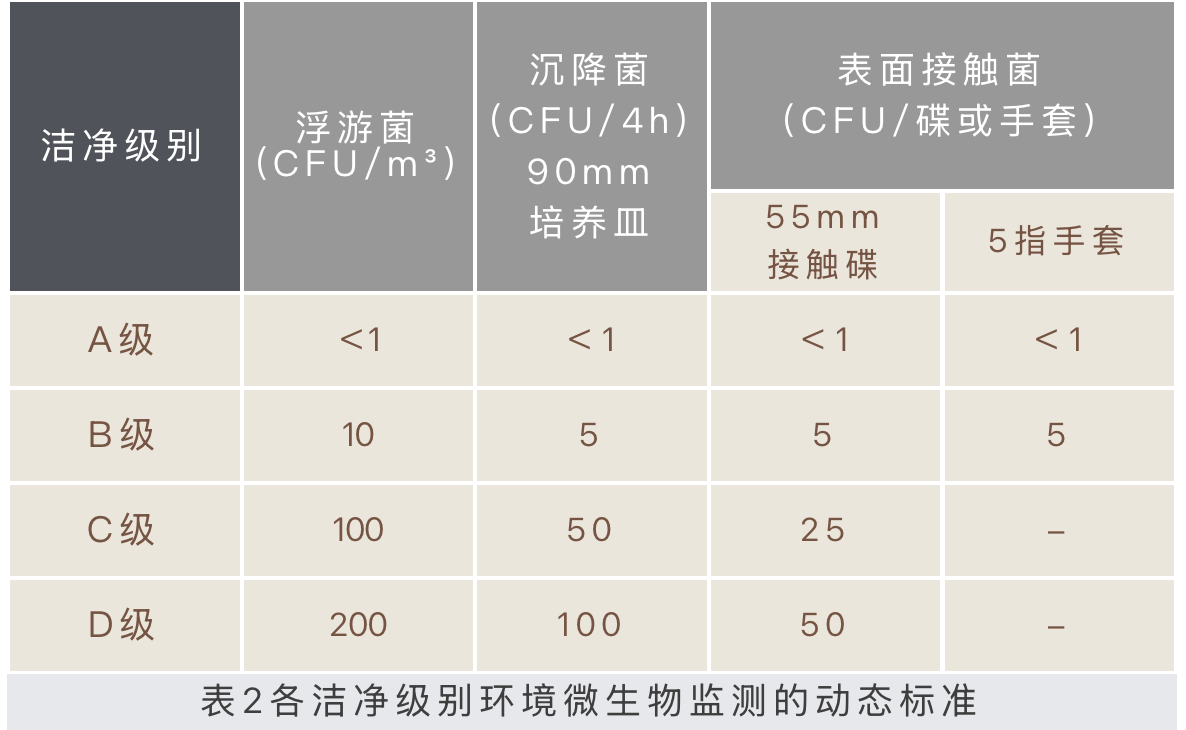
关于浮游菌与沉降菌的检测方法,主要是采用GB/T 16293 《医药工业洁净室(区)浮游菌的测试方法》与GB/T 16294 《医药工业洁净室(区)沉降菌的测试方法》,连同GB/T16292这一系列标准均实行接近十五年,目前业已修订升级,处于审查阶段,即将报批发布。根据征求意见稿,新版大体上与国际接轨,删除了一些不合时宜的要求,增加了培养基的要求,明确沉降菌测试用培养基种类,并提出培养基应符合《中华人民共和国药典》的相关要求,其中包含培养基的配方及其配制、贮藏、灭菌、质量控制等要符合中国药典1105、 9203的相关要求。另强调在进行培养基适用性检查时,应采用“培养计数”中的培养方案以验证所采用培养温度及培养时间的适宜性。
如下表为一个典型的无菌产品洁净区的环境监测配置方案,当下的监测计划需要10台Memmert IPP750ecoplus低温培养箱,外加一台IF750plus生化培养箱。在参考时,可根据相应的风险评估与采样点布局调整培养箱的尺寸大小与搁板数量多少。

洁净区微生物监测是药品无菌保障的核心组成部分,由于微生物在温度、湿度等条件适宜的情况下会不断的生长和繁殖,所以要做到动态管控。基于全面质量管理的“人、机、料、法、环”五要素,需构建结构化、闭环化的微生物监测与控制体系,融合一些新型技术手段,诸如快速PCR检测(4小时出结果)、物联网传感网络与AI预测, 把微生物监测做好,为高质量药品发展提供技术保障。同时还要注意消毒剂轮换策略的灵活运用。